蛋白纯化是指通过基因工程技术将编码蛋白的核酸序列导入到宿主细胞,使其大量表达,再使用适当的纯化方法将其在体外纯化出来,从而获得高纯度、活性和产量的蛋白质。蛋白质表达系统可以分为原核表达系统和真核表达系统两大类,我们今天主要来看下原核表达系统!
乳糖操纵子的神奇开关:
原核系统的核心秘密藏在lac操纵子!平时阻遏蛋白锁死基因表达,但加入IPTG后秒变超级开关——这个稳定耐造的诱导剂能骗过细菌,24小时持续激活蛋白表达,产量直接拉满!
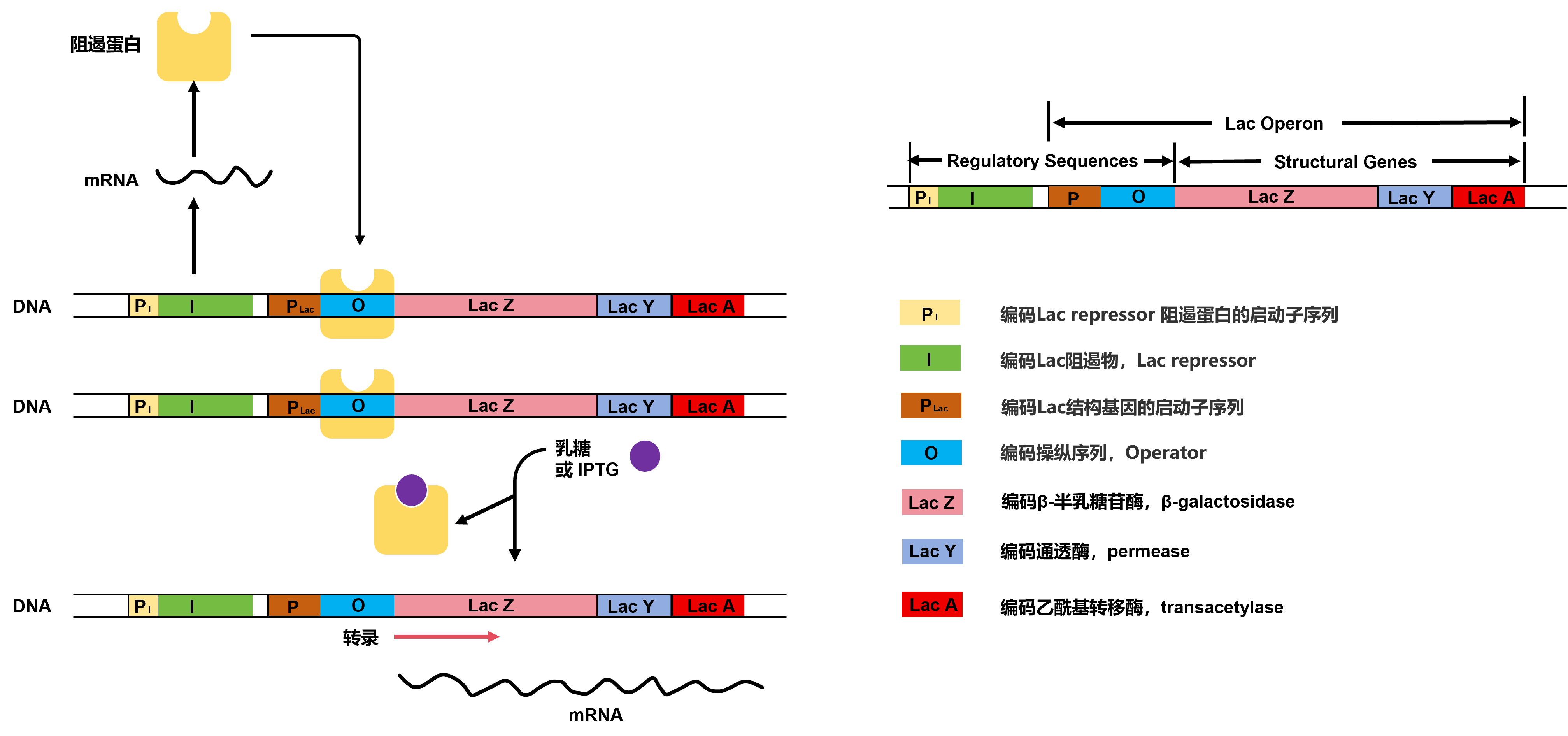
Figure 1 乳糖操纵子和IPTG原理示意图
宿主菌株怎么选?
BL21:新手友好型!适合普通非毒性蛋白,具有大肠杆菌聚合酶,故可适用于tac或trc等使用大肠杆菌RNA聚合酶的原核系统的表达(如:pGEX,pMAL质粒)。
BL21(DE3):双引擎驱动!在BL21菌株的染色体上整合了λ噬菌体DE3区的T7噬菌体RNA聚合酶基因,加上大肠杆菌RNA聚合酶,适配pET系列,pGEX,pMAL等高端质粒。
重要Tip:DE3菌株遇到毒性蛋白会自我毁灭,记得改用特殊菌株如:BL21 AI、BL21 (DE3) pLysS、BL21 (DE3) pLysE、Lemo21(DE3)、C41(DE3)、C43(DE3)和M15 pREP4。
|
需求场景 |
优选菌株 |
核心优势 |
|
极低本底表达 |
BL21 AI / Lemo21(DE3) |
动态调控T7聚合酶活性 |
|
毒性蛋白表达 |
C41(DE3)/C43(DE3) |
突变耐受性+溶菌酶抑制双重保险 |
|
可溶性蛋白生产 |
Origami/Rosetta系列 |
氧化还原环境优化+密码子适配 |
|
高严谨性克隆筛选 |
M15 pREP4 |
lac抑制蛋白强力阻断本底泄露 |
蛋白纯化四部曲:
1. 基因改造:His标签/NusA融合,给蛋白装上GPS!PCR扩增目的基因,双酶切基因片段与载体后连接,转化至DH5α感受态,挑取单菌落培养,提取质粒并进行测序验证,将阳性重组质粒热激转化至BL21(DE3),涂布含抗生素LB平板,37℃过夜培养
2. 诱导表达:挑取单克隆接种于3 mL LB培养基,37℃振荡培养12-16 h。按1:1000比例转接至新鲜培养基,37℃培养至OD600达0.6-0.8时,设置梯度诱导体系:分别考察IPTG浓度(0.1-1.0 mM)与诱导温度(16℃、30℃、37℃)的协同效应,其中低温诱导时间延长至16-20 h(16℃)或6-8 h(30℃)。通过SDS-PAGE分析诱导前后菌体蛋白表达差异,筛选可溶性表达最佳条件。
3. 大规模蛋白诱导与菌体收集:采用优化条件进行2 L规模发酵。菌体离心(4000 g,4℃,15 min)后按1:10 (w/v)比例加入预冷的裂解缓冲液(含1% Triton X-100,20 mM咪唑及蛋白酶抑制剂),冰浴30 min。高压均质仪于800 kPa压力下循环破碎3-5次,直至菌液透明度显著增加。离心收集上清(12000 g,4℃,20 min),分离可溶性与包涵体组分。
4. 亲和层析:使用Ni-NTA树脂进行金属螯合层析。首先用5倍柱体积裂解缓冲液平衡层析柱,将含有His标签蛋白的裂解上清与树脂4℃结合2 h。依次用含40 mM、60 mM咪唑的洗涤缓冲液去除杂蛋白,最后用250 mM咪唑洗脱缓冲液分步洗脱目的蛋白。全程收集各阶段流出液进行SDS-PAGE监控。

Figure 2 原核表达系统纯化蛋白全流程
为什么选His标签?
组氨酸标记(His-tag)是最常用的标签之一,通过在蛋白N端或C端添加6-10个组氨酸残基,使其能够特异性结合Ni2+螯合介质。该结合作用在非变性或变性条件(如8M尿素)下均稳定存在,最终通过咪唑溶液竞争性置换结合His-tag的Ni²+,实现目标蛋白的特异性洗脱与纯化。
关键优化策略
(1)采用低温诱导(16℃)结合低浓度IPTG(0.2 mM)有效提升可溶蛋白比例
(2)在裂解缓冲液中添加0.5 M精氨酸显著减少非特异性吸附
(3)梯度咪唑洗涤(20-60 mM)使纯度提高约35%。
原核表达虽“快准狠”,但复杂蛋白(如含二硫键、翻译后修饰)建议转向真核系统哦!
普健生物(AtaGenix)专注于蛋白抗体开发,其核心优势之一是成熟高效的五大蛋白表达系统,覆盖原核与真核体系,可满足不同蛋白的表达需求。大肠杆菌原核表达系统有表达量高,成本低,周期短,发酵工艺成熟等优势,真核表达系统包含哺乳动物细胞(支持复杂翻译后修饰,适合抗体药物、Fc 融合蛋白)、昆虫细胞(超大分子兼容性,如跨膜蛋白和病毒样颗粒)、酵母(高密度发酵,中等复杂度蛋白)及植物细胞(安全性高、规模化生产治疗蛋白),满足从基础研究到药物开发的多样化需求。

 联系我们
联系我们





